在線客服
在線客服
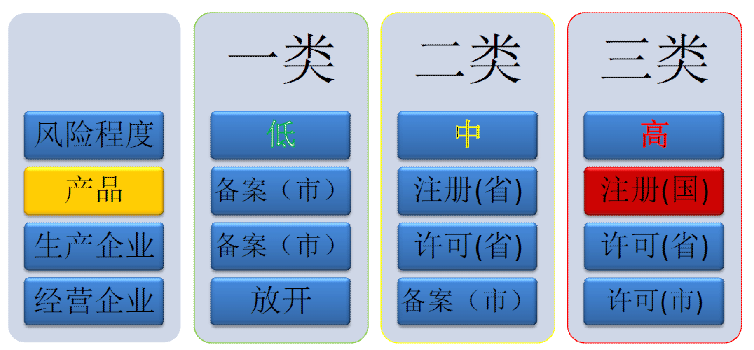
國內醫療器械注冊分類管理,一張圖告訴你!當產品被歸類為中等復雜時,申請人認為其產品符合豁免標準,并可向FDA提交CLIA WAIVER申請。關于CLIA WAIVER申請,FDA有相關的指導文件。有興趣的朋友可以查閱,不會在這里重復。指南名稱是:ApplicationStudies對雙510(k)和CLIA豁免的建議。
附錄1記分卡標準(42 CFR 493.17)
記分卡分為7個測試,每個測試分為3個分數:1、 2、 3. 1是最低復雜度,3是最復雜的。測試后,將七個測試的分數加在一起。 12級及以下的級別是中度復雜的測試,12級以上的測試是非常復雜的測試。當特定測試的特征在描述的1到3之間時,該值被指定為2。
(1)國內醫療器械注冊知識
(i)1分:(A)需要最少的科學和技術知識。 (B)可以通過工作描述獲得操作所需的知識。
(ii)3分:在檢查分析之前、分析、分析后需要專業知識。
(2)國內醫療器械注冊培訓和經驗
(i)1分:(A)在分析、分析和分析后訓練之前需要最少的訓練。 (B)需要有限的經驗
(ii)3分:(A)需要專業培訓才能在、分析之前完成分析、分析后操作或(B)保證檢測性能需要豐富的經驗
國內醫療器械注冊周期
- I類當場備案,但是現在大部分城市的藥監局需備案者網上遞交,通過初審才能去現場遞交,無形中拉長了I類備案的時間。
- II類,93個工作日,這個只是藥監局官方給的評審時間,且提交資料符合要求的情況下,如果資料不符合要求,會要求增補,周期會加長。
- III類,123個工作日,同樣的,這是官方公布的初次評審的時間周期,根據具體的項目情況,注冊周期會增加。
國內醫療器械注冊費用
產I類不收取費用;
國產II類8-9萬,各地藥監局收費標準稍有不同;
國產III類15.36萬;
進口I類不收取費用;
進口II類21.09萬;
進口III類30.88萬。
隨著科技的發展,醫療器械在醫療領域的應用越來越廣泛。為了確保醫療器械的安全性和有效性,飛行檢查成為一種重要的質量控制手段。本文將介紹醫療器械......
為進一步規范人工智能醫療器械的管理,國家藥監局器審中心組織制定了《人工智能醫療器械注冊審查指導原則》,現予發布。 特此通告。 ......
北京、天津、河北、遼寧、黑龍江、上海、江蘇、浙江、安徽、福建、山東、河南、湖北、湖南、廣東、廣西、海南、重慶、四川、云南、陜西省(自治區、直......
據近日俄羅斯《消息報》報道,俄羅斯托木斯克工業大學科研人員,把聚乙內酯放入磁控管放電等離子體中進行處理,研發出一種能更好地治療急性血栓的新型......
......
最近很過客戶電話咨詢經營第一類醫療器械是否需要備案,下面廣州安思泰的小編給大家回答這個問題。經營第一類醫療器械是不需要備案的。根據新的醫療器......
廣州安思泰企業管理咨詢有限公司目前公司已服務1000多家客戶。公司的服務得到客戶的一致好評,并且成為了長期的合作伙伴。為醫療器械生產企業、經......
醫療器械如何分類,是要備案還是注冊?很多人傻傻不清楚,下面由廣州安思泰企業管理咨詢有限公司的小編為大家整理,希望能有所幫助。......
為進一步規范醫療器械軟件的管理,國家藥監局器審中心組織制定了《醫療器械軟件注冊審查指導原則(2022年修訂版)》,現予發布。 特此通告......
東莞客戶與2021月08月順利通過省局專家組織的體系現場考核。再次感謝客戶的全力配合及公司輔導老師的專業。......