在線客服
在線客服
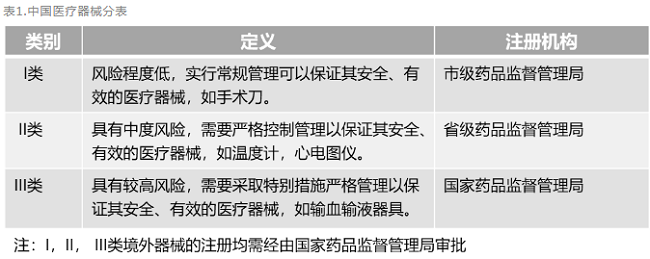
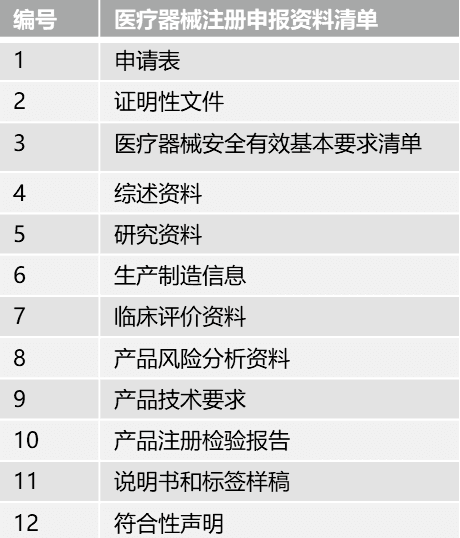
醫療器械是指直接或者間接用于人體的儀器、設備、器具、體外診斷試劑及校準物、材料以及其他類似或者相關的物品,包括所需要的計算機軟件。不同種類的醫療器械在人體中使用時風險程度具有差異,為了便于監管,我國對醫療器械按照風險程度實行分類,具體分類見下表。
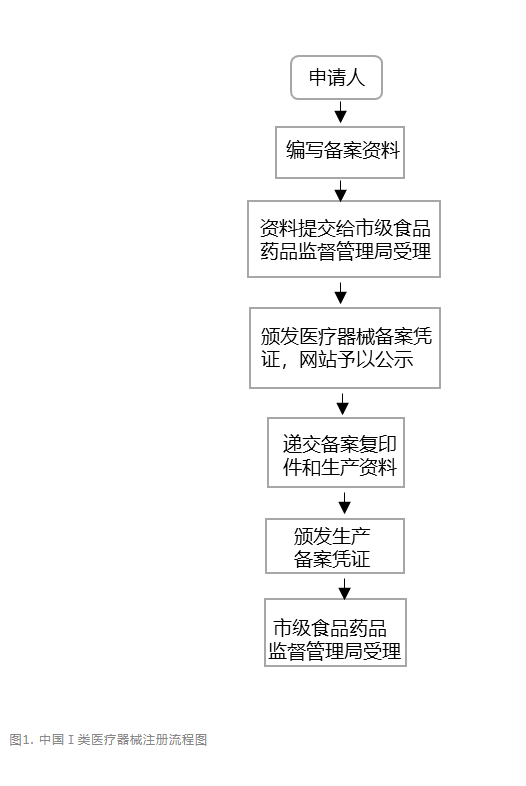
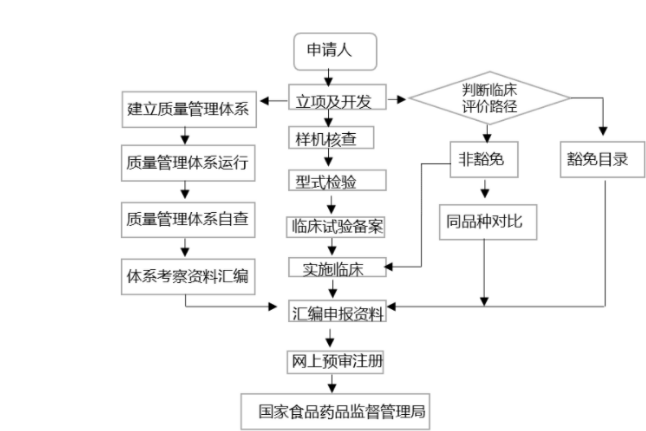
目前,在中國涉及醫療器械注冊的主要是由國家藥品監督管理局(NMPA)下的醫療器械技術審評中心(CMDE)負責。CMDE下設質量管理部,合規部,項目管理部,審評部,臨床與生物統計部等部門,負責起草、擬訂和修訂醫療器械的行業標準、生產質量管理規范,制定醫療器械產品分類管理目錄,開展注冊審批和監督。中國目前醫療器械上市準入的法規依據是《醫療器械注冊管理辦法》。根據該法規,針對第Ⅰ類器械,境內生產企業需要在所在地設區的市級藥監局進行注冊備案和生產許可備案,境外醫療器械生產企業需要委托境內代理人在國家藥監局進行相應備案。
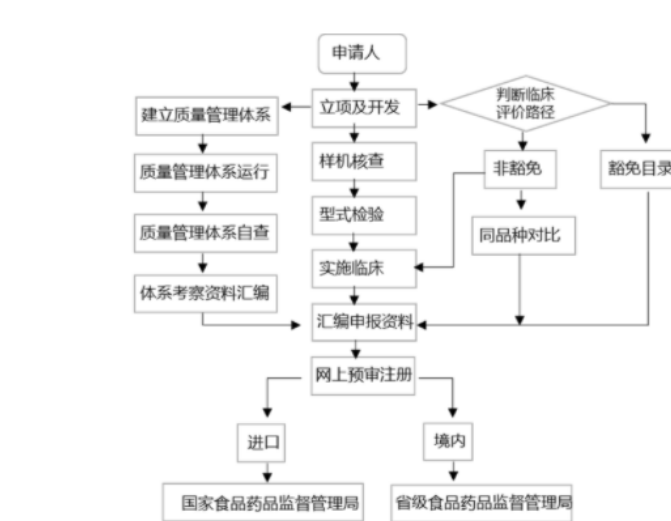
針對第Ⅱ類器械,境內生產企業需要在所在地省(直轄市)藥監局進行注冊申請、產品檢驗(經國家認可的檢測機構監測)、質量體系考核申請、臨床驗證(是否實施需依據管理要求進行),境外醫療器械生產企業需要委托境內代理人在國家藥監局進行相應注冊。
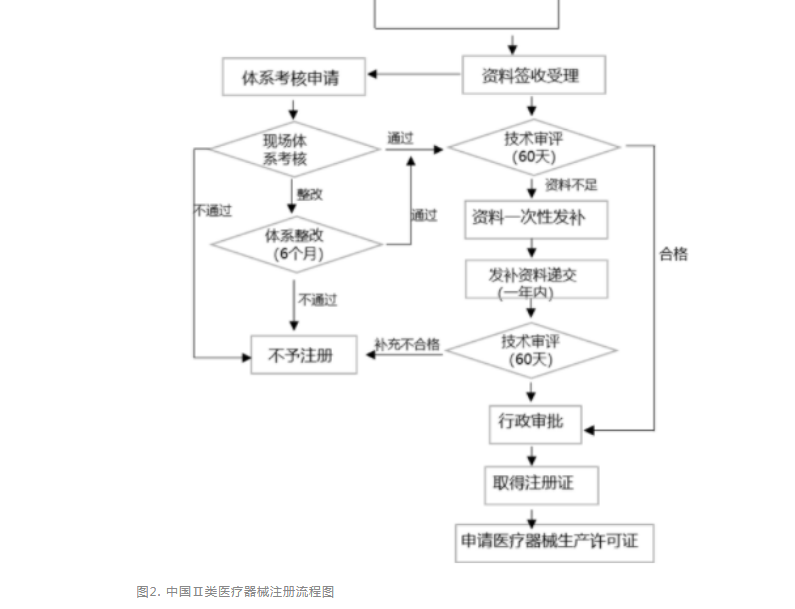
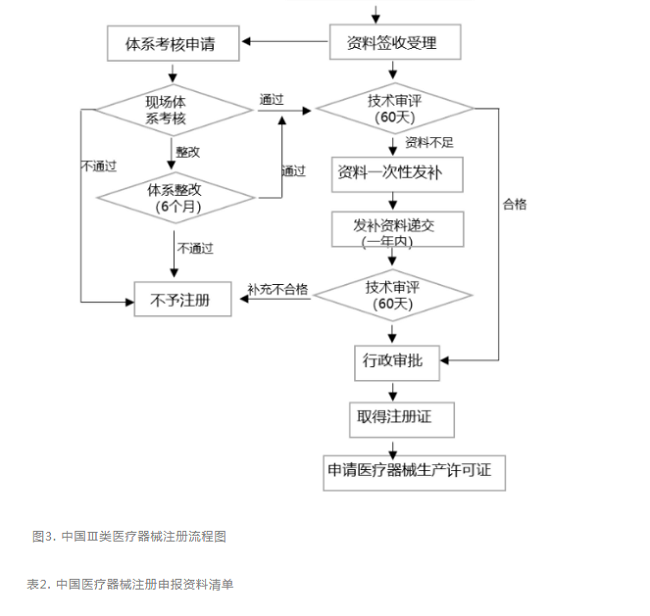
針對第Ⅲ類器械,無論境內、境外醫療器械生產企業均需要在國家藥監局進行注冊申請,產品檢驗(經國家認可的檢測機構監測)、產品臨床驗證(如有規定可申請免臨床)、質量體系考核申請。
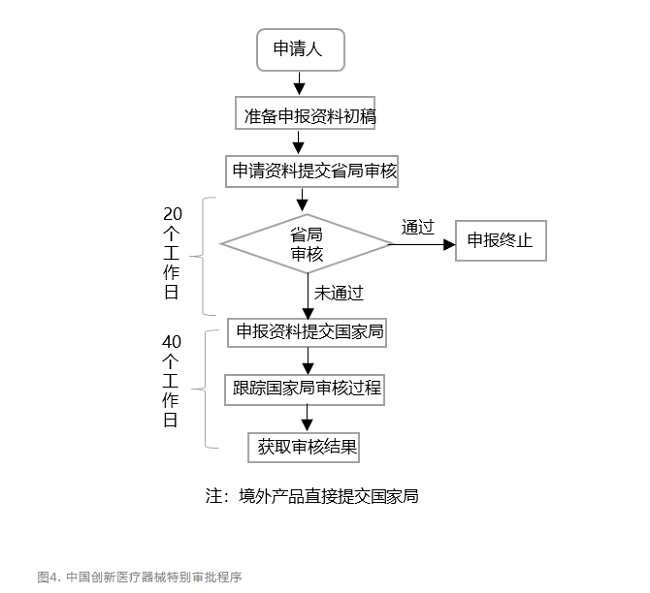
我國醫療器械行業起步晚,投入規模和核心技術與國際巨頭存在一定的差距。行業呈現出“大而不強”的現狀。為了擺脫這種狀況,我國在近年愈發重視醫療器械行業創新。尤其在高端醫療器械領域,提出了“國產替代”的理念,并發布了創新醫療器械審批程序。這一措施對鼓勵醫療器械的研究與創新,促進醫療器械新技術的推廣和應用,推動醫療器械產業發展起到了積極作用。對于符合1、擁有產品核心技術發明專利權。2、產品主要工作原理或作用機理為國內首創,技術領先,安全性有根本性改進,具有顯著的臨床應用價值。3、具有基本定型的醫療器械,可以考慮申請創新醫療器械特別審批。國家食品藥品監督管理總局醫療器械技術審評中心專門設立了創新醫療器械審查辦公室并給與了一定的審批流程政策利好,如優先辦理質量管理體系考核申請,制定專人進行溝通,提供指導,優先進行技術評審和行政審批。大致申請審批流程見圖4。
此外,需注意中國的注冊證書具有5年的有效期。效期屆滿需要延續注冊的,注冊人應當在醫療器械注冊證有效期屆滿6個月前,向藥品監督管理部門申請延續注冊,獲得新的注冊證書后產品才能繼續上市銷售。已注冊的第二類、第三類醫療器械產品,其設計、原材料、生產工藝、使用范圍、使用方法等發生實質性變化,有可能影響該醫療器械安全、有效的,注冊人應向原注冊部門申請辦理變更注冊手續。發生非實質性變化,不影響該醫療器械安全、有效的,應當將變化情況向原注冊部門備案。
為進一步規范醫療器械軟件的管理,國家藥監局器審中心組織制定了《醫療器械軟件注冊審查指導原則(2022年修訂版)》,現予發布。 特此通告......
2019年09月,我司與深圳客戶簽訂無菌醫療器械注冊、體系、生產許可證服務項目。......
......
廣州安思泰企業管理咨詢有限公司是一家專業從事國內醫療器械行業注冊咨詢公司,為客戶提供專業的咨詢服務,公司奉行“圍繞法規、標準,專業服務客戶,......
......
進行醫療器械備案需要滿足一系列的條件,包括申請人的資質、產品信息和資料、產品質量和服務體系、備案流程和要求等,以確保醫療器械的質量和安全性,......
2019.04月指導企業取得了2個產品II類-醫用外科口罩、醫用防護口罩的注冊證,2019.06月最終取得了醫療器械生產許可證,至此幫助企業......
有不少的朋友想注冊公司做生意的,但是現在注冊一家醫療器械公司公司需要怎么做呢?如何注冊一個醫療器械公司,今天廣州安思泰的小編就和大家一起來了......
近日,國家藥品監督管理局經審查,批準了北京市春立正達醫療器械股份有限公司生產的創新產品“單髁膝關節假體”注冊。......
在醫療器械生產領域,醫療器械生產許可證是必不可少的證件之一。只有擁有該證件,企業才能在國內生產、銷售醫療器械。但是,申請醫療器械生產許可證是......