在線客服
在線客服
我國對醫療器械采用上市前審批和上市后監管的方式來保證產品的安全性。按照我國的醫療器械監管法規,在我國境內銷售、使用的醫療器械均應進行注冊,醫療器械注冊主要包括注冊檢驗、臨床試驗、注冊審批、質量體系核查等必經環節,這些環節也是監管過程中至關重要的關鍵環節。
一、我國醫療器械注冊現狀與痛點
近年來,隨著醫療器械法規的不斷完善,國家對醫療器械注冊的審評越來越嚴,對醫療器械企業的研發能力和生產能力要求越來越高,企業的投入也越來越大,企業要想盡早獲得利潤,就需要盡快注冊上市,才能有資質正常銷售。所以醫療器械注冊的快慢直接影響著醫療器械企業在市場上的競爭力和市場占有率。
然而,企業在醫療器械注冊過程中仍然存在著很多問題,如注冊檢驗過程中排隊時間長、注檢項目無法一次性通過,臨床試驗周期長、花費大,注冊審批速度慢等,這些都是導致產品無法快速上市的因素,從而不利于醫療器械產品的創新和產業的發展。對于注冊過程中的關鍵環節,存在著如下現狀與痛點:
1注冊檢驗
注冊檢驗是產品上市前評價的第一個主要環節,生產企業在申請注冊檢驗前,應選擇具有醫療器械檢驗資質、在其承檢范圍內的醫療器械檢驗機構。
目前,各省(自治區、直轄市)均設立了相應的醫療器械檢驗機構,其分布與當地醫療器械產業發展狀況緊密相關。醫療器械產業發達的省份,其檢驗機構能力較強,數量也相對較多于欠發達地區;欠發達地區醫療器械生產企業數量少、規模小,檢驗機構的數量和認可能力項目也都相對較少,從而導致相對發達的省市,注檢機構“門庭若市”,企業注檢排隊甚至超過半年以上,而相對欠發達的省市,注檢機構“門可羅雀”,也造成一定程度的資源浪費。
另外,對于企業注檢項目而言,由于檢驗項目繁多,在檢驗過程中就會出現無法一次性通過驗證的情況,對于無法通過檢驗的項目,需要企業進行反復整改,直到整改通過后方可獲取注檢報告,這樣就大大增加了企業的注檢時間,影響企業注冊上市。
2臨床試驗
臨床試驗是驗證醫療器械上市前安全性和有效性的核心方法之一,也是影響注冊審批速度的關鍵環節之一。臨床試驗一般是申辦方(即企業)、實施者(即臨床機構)及服務方(CRO服務等)共同完成,目前,醫療器械的臨床試驗實施者和臨床機構都須按照《醫療器械臨床試驗規定》進行臨床試驗,在此期間,他們對醫療器械臨床試驗的管理、維護受試者權益、保證臨床試驗結果真實可靠起到了一定的作用[3]。
但在執行過程中,由于法規制度不夠完善、申辦者和研究者不夠重視、臨床試驗質量不高等現象,致使臨床試驗過程中存在很多問題和不足,例如標準操作規程(SOP)不完善、對數據的可靠性沒有進行核查、對數據進行造假、試驗方案設計不合理、評價標準不規范、資料文件存放與管理不規范等,都有可能對臨床試驗的安全性、有效性造成影響[4],最終導致注冊審批無法通過。
3注冊審批
注冊審批是對擬上市的醫療器械的安全性和有效性研究及其結果進行系統評價、判定風險受益比的過程,包括注冊申報資料、技術審評、質量管理體系核查等環節,同樣在注冊審批過程中也同樣遇到很多問題,例如在申請注冊時一般都會遇到提交產品補充材料的情況,嚴重影響了注冊審批效率,也影響了企業創新的積極性,由于資料的不完善甚至資料的不合規都有可能造成退審而無法注冊,都將會給企業帶來一定的經濟困難,影響企業正常運作。
另外按照法律規定,第三類器械都要在國家藥監局進行注冊審批,這就會出現擁擠排隊,超過法規規定的審批時限,從而給企業造成難以挽回的生產和銷售混亂,尤其是在產品申請重新注冊時。
注冊審批過程中的質量體系核查也是影響企業上市的一個風險點,具體而言,就是對申請產品樣品的研制、生產、檢驗、倉儲等管理情況進行核查,進而判斷該企業的質量管理體系可否有效分析并控制產品質量風險,進而得到企業申請產品樣品真實、客觀、可靠結論。但從核查情況看,醫療器械注冊核查幾乎沒有一次性通過的,原因在于存在多種缺陷,包括生產機構及人員、產品開發、生產設施設備、生產管理、生產質量控制及文件管理等方面的缺陷。
二、醫療器械注冊流程分析
醫療器械企業前期大都注重研發,而忽略了體系建設,由于資金的原因,也很少配置自己的注冊團隊,致使企業在注冊過程中常存在著業務不熟悉、流程不清晰、人員不專業等問題,審批過程中就會出現不停補充、修改資料等情況,甚至造成注冊申請被退回,耽誤產品上市時間,給企業造成巨大的損失。
我國醫療器械產品分類,根據《醫療器械分類目錄》,我國醫療器械產品分三大類管理。其中,第一類是指,通過常規管理足以保證其安全性、有效性的醫療器械。第二類是指,對其安全性、有效性應當加以控制的醫療器械。第三類是指,植入人體;用于支持、維持生命;對人體具有潛在危險,對其安全性、有效性必須嚴格控制的醫療器械。

以第三類醫療器械注冊過程中的注冊審批流程為例,分析企業所需的注冊時間:
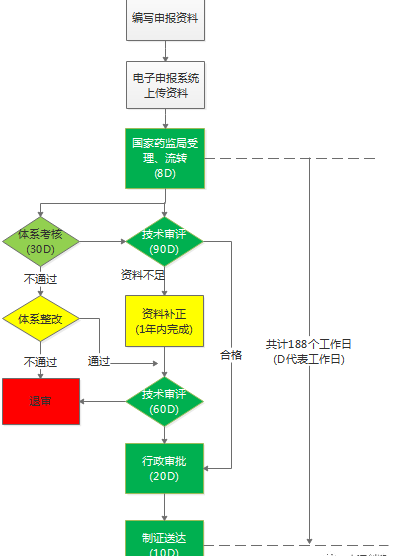
上圖:第三類醫療器械注冊審批流程
根據《醫療器械注冊管理辦法》,按照正常流程,第三類醫療器械注冊審批所需時間至少為188個工作日(即約10個月時間),但考慮到一年內資料補正期的資料補正時間、體系審核整改時間、外聘專家評審時間等因素,企業僅僅在注冊審批環節所需的時間就大約要一年半甚至更久。因此注冊審批周期過長、效率低,進而給企業帶來巨大的經濟壓力,嚴重影響了產品的快速上市,也是企業迫切渴望解決的問題之一。
三、大數據及AI技術助力醫療器械注冊提速
基于以上現狀,醫療器械企業為了加快注冊,通常都會尋找注冊服務機構,然而在尋找過程中,同樣遇到各種問題:
(1) 注冊服務機構的服務質量參差不齊、各自擅長的領域不一、無法找到合適的服務機構;
(2) 器械企業在尋找過程中不僅花費了大量的時間和精力,而且不專業的服務可能致使注冊失敗,服務機構也可能推諉扯皮,給企業造成更大的損失;
(3) 醫療器械注冊涉及器械企業的機密信息,器械企業很害怕選擇了不正規的注冊服務機構,泄露信息;
(4) 對于服務機構而言,每年要花費大量的運營成本進行尋客,且效果并不十分理想。
因此傳統模式已經無法滿足醫療器械注冊加速的需求,對于企業和服務機構而言,都迫切需要一個專業的平臺來提供這些服務項目的支持,這也是醫療器械注冊行業未來的大趨勢。
因此,需要一方面利用好大數據及AI技術,把全球生物醫藥(包括醫療器械)資源線上化,打造專業的數字化創新服務平臺,通過供需雙方企業的數字化畫像和需求預測模型的構建,實現器械企業注冊服務需求的精準匹配,幫助供需雙方快速找到對方;另一方面通過打造專業的運營團隊,幫助供需企業線下精準對接,實現全流程品控。通過線上線下相結合的服務模式,幫助醫療器械企業在注冊方面實現降本提效、加速創新。
另外,隨著醫療器械注冊人制度的全面實施,企業可以通過委托研發或生產的方式(即CDMO)獲得注冊證和生產許可證。結合能夠服務全生命周期的數字化服務平臺和線下專業運營的服務對接,形成專業化創新設施與平臺的一體化服務,未來將大幅降低企業的注冊成本、縮短拿證時間、加速上市周期,為整個行業的創新發展起到推動作用。
感謝老客戶的認可,再次選擇我司協助完成血氧探頭增項業務。......
國家藥監局 國家衛生健康委關于發布定制式醫療器械監督管理規定(試行)的公告(2019年 第53號) ......
一類醫療器械的注冊流程,依照法定程序,進行申請注冊。一類醫療器械注冊申請材料:(一)境內醫療器械注冊申請表;......
醫療器械注冊常見問題解答有哪些?下面小編給大家整理以下內容。......
熱烈祝賀天河區客戶取得第三類醫療器械經營許可證......
辦理第2類醫療器械經營備案企業已經取得第三類醫療器械經營許可證的,在辦理醫療器械經營許可時已經提交的資料,在辦理備案時無需再提交,可簡化......
......
近日,山東省淄博市醫保局發布《關于七市醫用耗材聯合采購擬中選企業及產品名單的公示》,公布了注射器、導尿管、導尿包、吸氧裝置、采血針5類共19......
我國醫療器械共有三類,其中,三類醫療器械屬于高危風險類產品,在生產經營上都有嚴格的管控措施。下面有這一起案例,余姚市市場監管部門工作人員對某......
2019年05月,我司順利幫助佛山順德客戶取得手動輪椅車注冊證,得到客戶對我司專業的一致認可。......