在線客服
在線客服
醫療器械注冊人制度允許醫療器械注冊申請人可以是醫療器械企業、研發機構、科研人員、醫生專家等主體,激發了醫療器械行業的創新和創業熱情。
該制度允許醫療器械注冊人將生產委托給多個有資質和生產能力的企業,極大地便利了具有研發能力的人員和機構的技術轉化,有利于科研成果的轉化輸出和創新產品的上市。
醫療器械注冊人制度要求注冊人對醫療器械設計開發、臨床試驗、生產制造、售后服務等全生命周期產品質量承擔全部責任的制度,促進產業發展的同時也明確了注冊人的權利與義務,有利于監管機構有效監管。
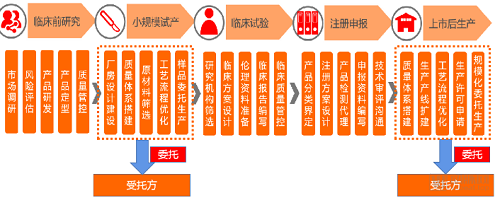
(醫療器械生產流程及委托生產介入環節)
醫療器械注冊人制度中關于委托生產模式的規定促進了行業精細化分工。該制度允許注冊人多點委托生產,使企業不再必須自建廠房。這將使擅長研發的只需專注研發,擅長生產的只需專注生產,大大提高了行業資源利用率,對于企業創新和產業升級有巨大幫助。另外,委托生產模式將在醫療器械的某些細分領域促進醫療器械研發機構與制造企業更趨向于精細化分工合作,優化行業資源配置。
醫療器械注冊與生產“解綁”,降低了醫療器械行業的進入門檻。資本、創業者、社會資源等在醫療器械注冊人制度下進入醫療器械行業更為便捷。這不僅擴大了醫療器械行業的市場規模,也提升了資源的利用率。
公司將會嚴格按照法規要求,專業輔導客戶順利通過藥監部門的審核拿到產品備案,給客戶帶來最大的收益。......
據深圳市市場監督管理局日常監管報告,深圳市10家第二、三類醫療器械生產企業未在《醫療器械生產許可證》登記地址從事生產經營活動且無法取得聯系。......
同一注冊證書內所包含內容,應符合《醫療器械注冊單元劃分指導原則》的要求。是否能夠在原注冊產品的基礎上新增型號、配件,取決于新增型號與原有......
2022年1月,國家藥品監督管理局共批準注冊醫療器械產品208個。其中,境內第三類醫療器械產品151個,進口第三類醫療器械產品21個,進口......
5月31日,國家藥監局發布公告,將于6月24日起正式啟用醫療器械電子申報信息化(eRPS)系統,并同步公布《醫療器械注冊申請電子提交技術指南......
醫療器械唯一標識(Unique Device Identification,簡稱UDI)是醫療器械產品的電子身份證,唯一標識數據載體是儲存或......
對于二類醫療器械的經營范圍,法律是有明確的規定的,比如說有6815注射穿刺器械、6820普通診察器械、6830醫用X射線設備、6831醫用X......
醫用超聲耦合劑是指在超聲診斷和治療操作中,充填或者涂敷于超聲探頭、治療頭與人體組織之間,用于透射超聲波的中介媒質。醫用超聲耦合劑分為“非無菌......
......
9月30日,國家藥品監督管理局、國家衛生健康委員會、國家醫療保障局聯合印發《關于深入推進試點做好第一批實施醫療器械唯一標識工作的公告》(以下......